一、二氧化碳性质验证
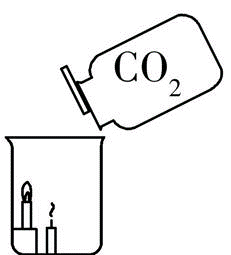
现象: 下 方蜡烛先熄灭, 上 方蜡烛后熄灭
结论:CO2 不能燃烧一般也不支持燃烧 (化学性质)、 密度比空气大 (物理性质)
2、与水反应
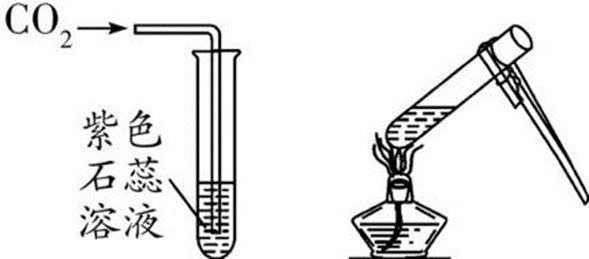
现象:紫色石蕊溶液变为 红 色;加热后又变为 紫 色
化学方程式: H2O+CO2▁( )/ H2CO3 、 H2CO3▁( △ )/ H2O+CO2↑
3、与澄清石灰水反应
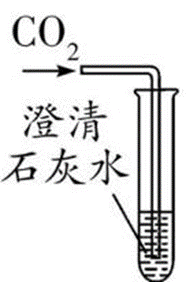
现象:澄清石灰水 变浑浊 化学方程式: Ca(OH)2+CO2 ==CaCO3↓+H2O (用于检验二氧化碳)
4、与氢氧化钠溶液反应
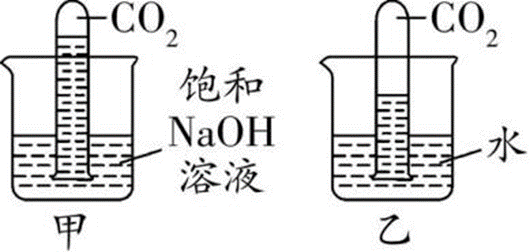
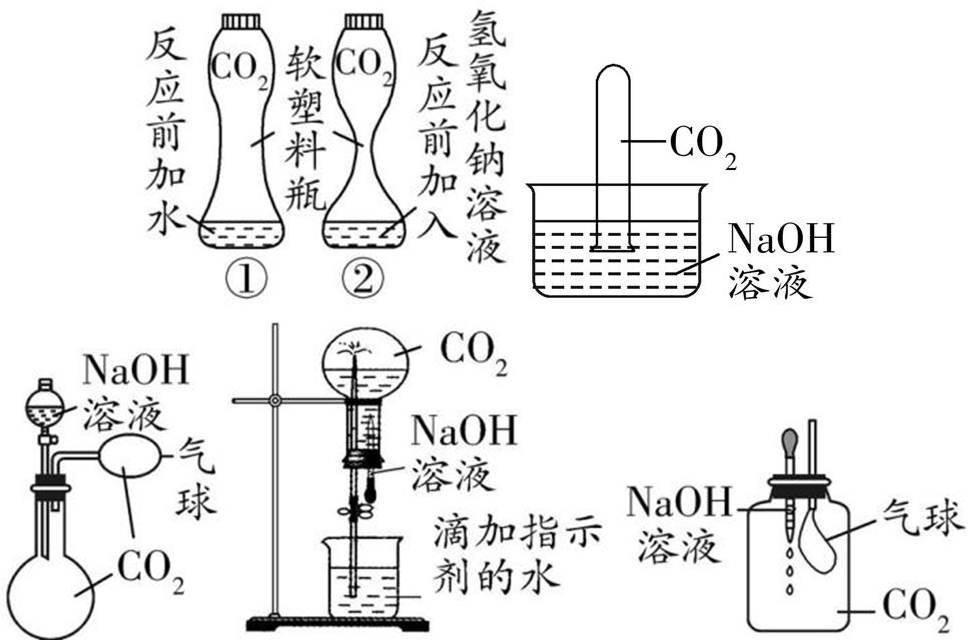
现象:甲中试管内液面比乙中试管内液面 高
化学方程式: CO2+2NaOH▁( )/ Na2CO3+H2O (用于吸收或除去二氧化碳)
5、CO2与两种碱溶液反应的对比
二、二氧化碳的实验室制取
1、药品:大理石(或石灰石)与 稀盐酸
2、反应原理:
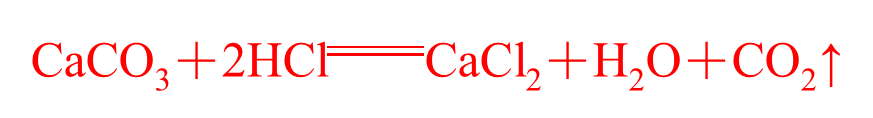
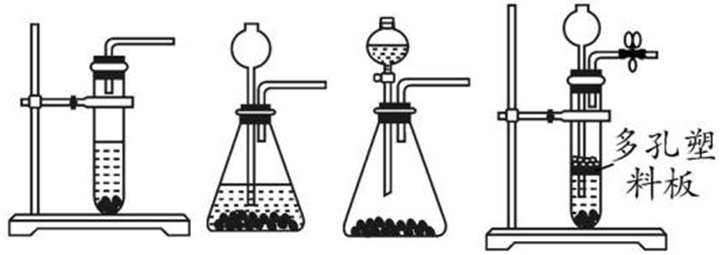
3、发生装置
4、收集装置5、
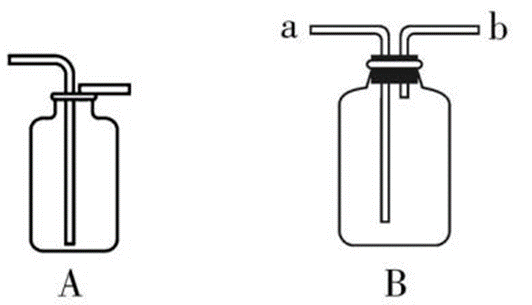
①选择A收集CO2的原因是 CO2的密度比空气大且不与空气中的成分反应 。收集时应注意: 导管的下端要伸到接近集气瓶的底部 ,以便排尽空气。
②选择B装置收集CO2时,进气口为 a
5、实验步骤
“查”:检查装置气密性;
“装”:把 块状大理石 装入锥形瓶,塞紧塞子;
“加”:从长颈漏斗加入 稀盐酸 ;
“收”:收集气体
6、检验:将产生的气体通入澄清石灰水中,若石灰水变浑浊,证明收集的是CO2
7、验满:将燃着的木条放在集气瓶口(或短导管口),若燃着的木条立即熄灭,证明CO2已收集满
8、实验反思
(1)能否用碳酸钠代替块状大理石(或石灰石),并说明原因。
不能,碳酸钠通常为粉末状,反应速率太快,不方便收集。
(2)能否用稀硫酸代替稀盐酸,并说明原因。
不能,稀硫酸与石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石的表面,阻止反应的进一步发生,不能持续地产生CO2气体。
(3)能否用浓盐酸代替稀盐酸,并说明原因。
不能,浓盐酸具有挥发性,挥发出的氯化氢气体使收集的二氧化碳不纯。
(4)将收集的CO2气体通入澄清石灰水,石灰水不变浑浊的原因可能有哪些?
①盐酸浓度太大,导致CO2气体中可能混有较多氯化氢,不能生成CaCO3沉淀;②石灰水已完全变质。

